Advanced Nano StepEffects of impurities on perfection of protein crystals, partition functions, and growth mechanisms

| 宇宙利用/実験期間 | 2017年 ~ 2023年 |
|---|---|
| 研究目的 | Advanced Nano Step(以下AdNano)ミッションは、無重力でタンパク質結晶を成長させ、その成長する結晶の表面をこまかく観察して、「宇宙ではどうしてきれい(高品質)な結晶ができやすい(と言われている)のか」という謎を解明する実験です。AdNanoミッションでは、結晶の成長速度と、回収結晶の品質評価を行うことを目的としています。 |
| 宇宙利用/実験内容 | AdNanoミッションでは、回収結晶の品質評価(X線結晶構造解析および分配係数測定)と結晶成長セル以外は、全てNanoStepミッションで使用した実験装置を再使用します。 |
| 期待される利用/研究成果 | 「何故宇宙では良い結晶が得られることが多いのか」に対する答えを得るとともに、創薬の分野などに貢献できる可能性が高いと考えています。 |
| 関連トピックス | |
|
詳細
研究代表者
研究分担者
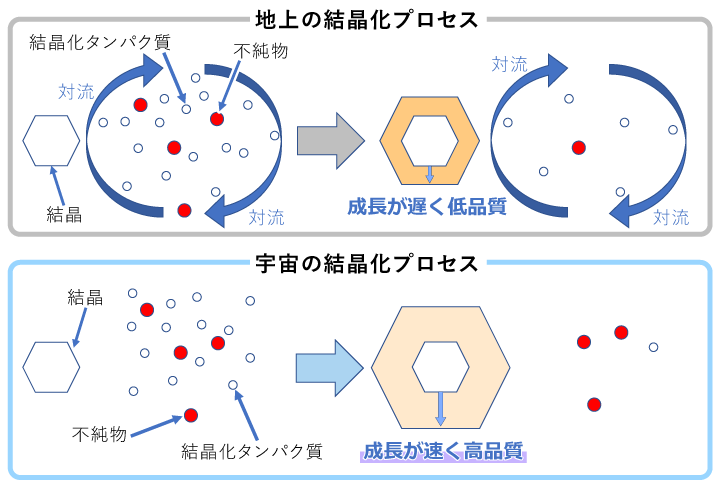
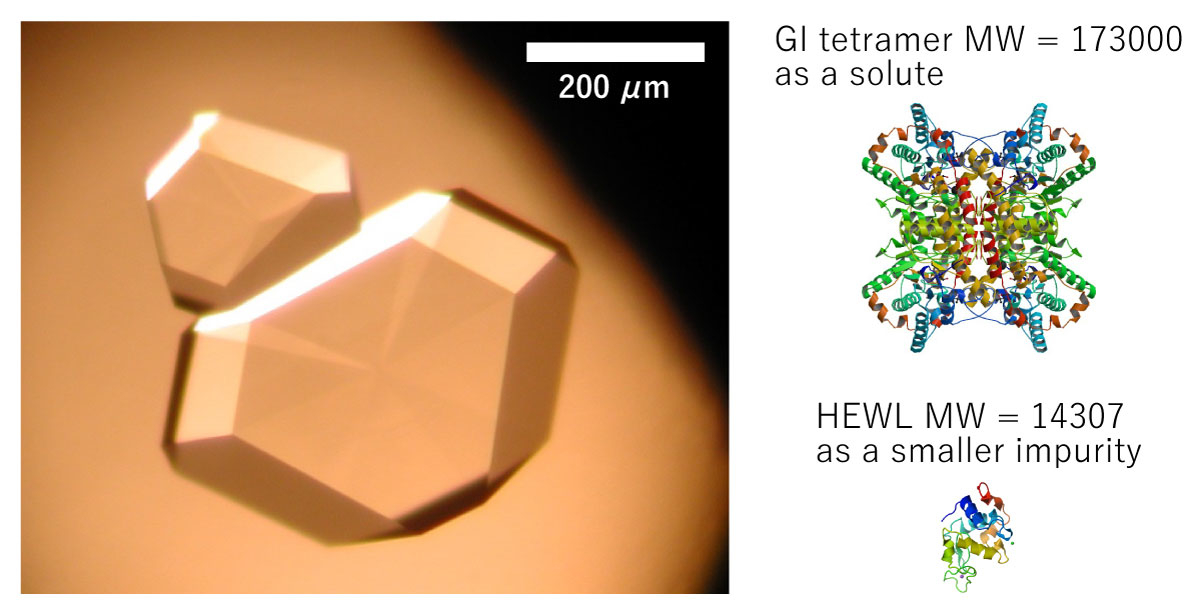
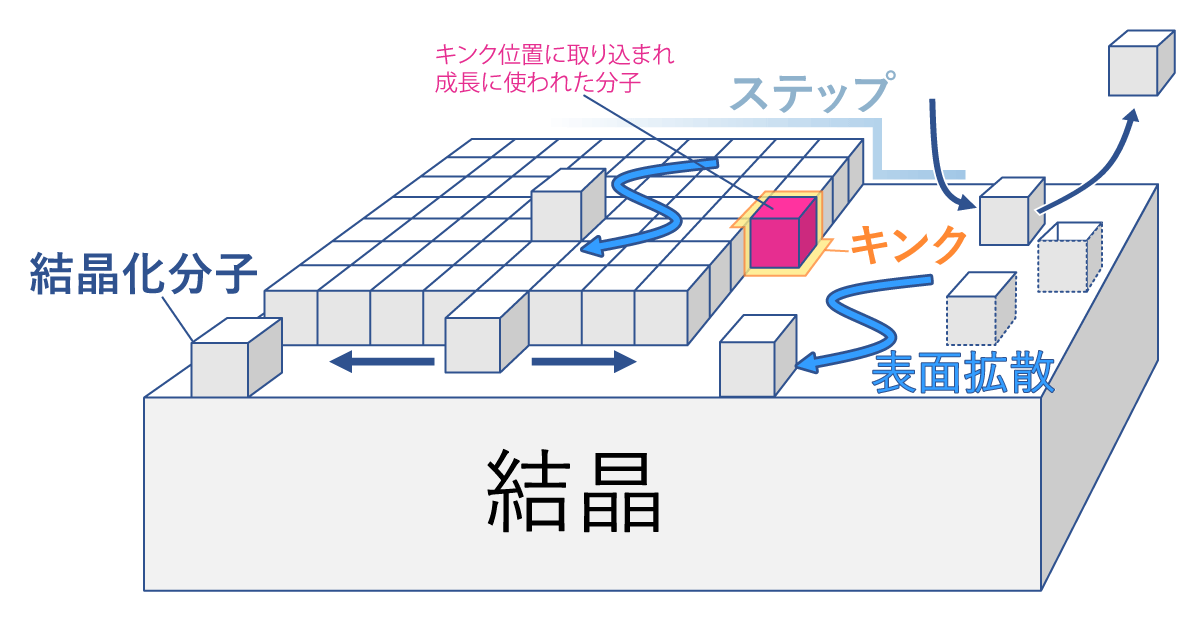
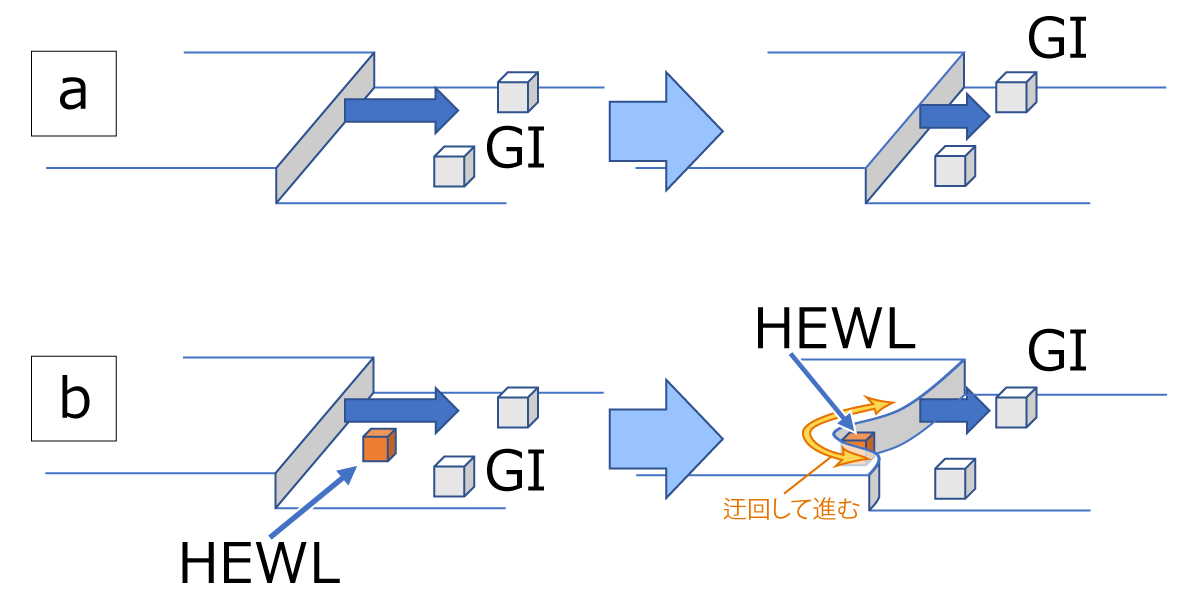
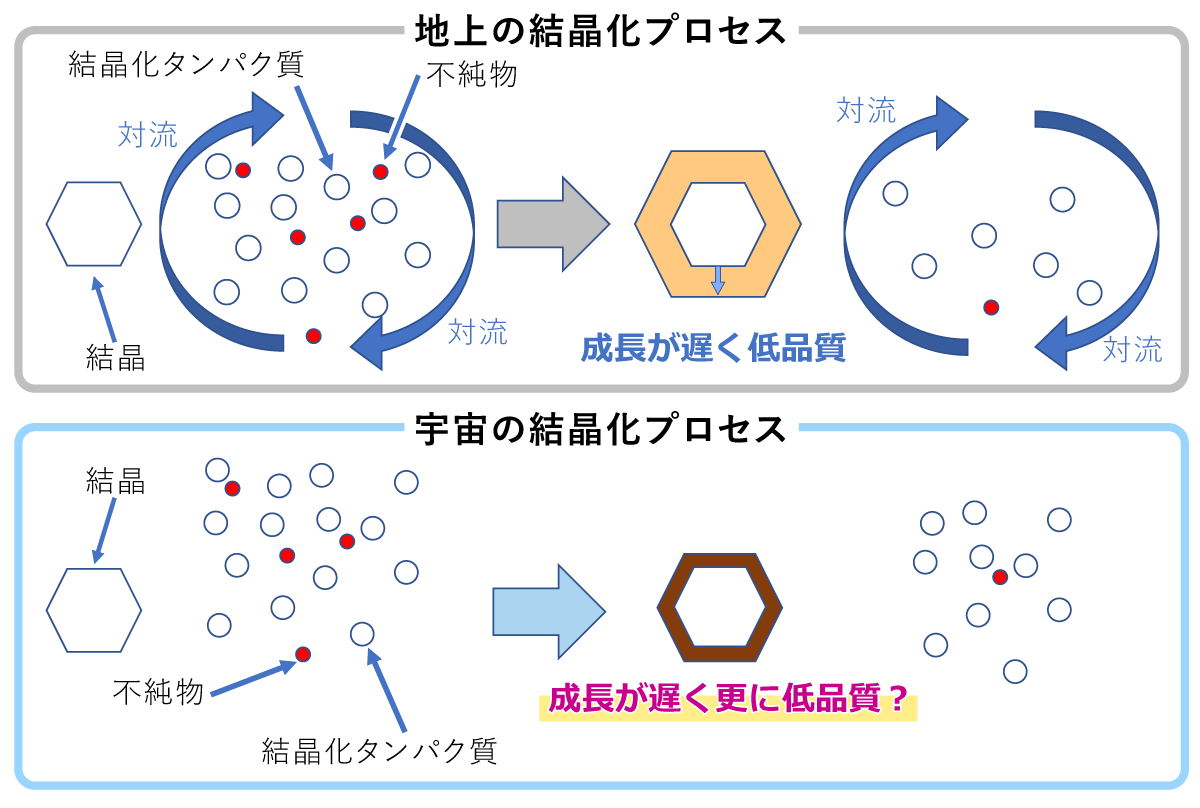
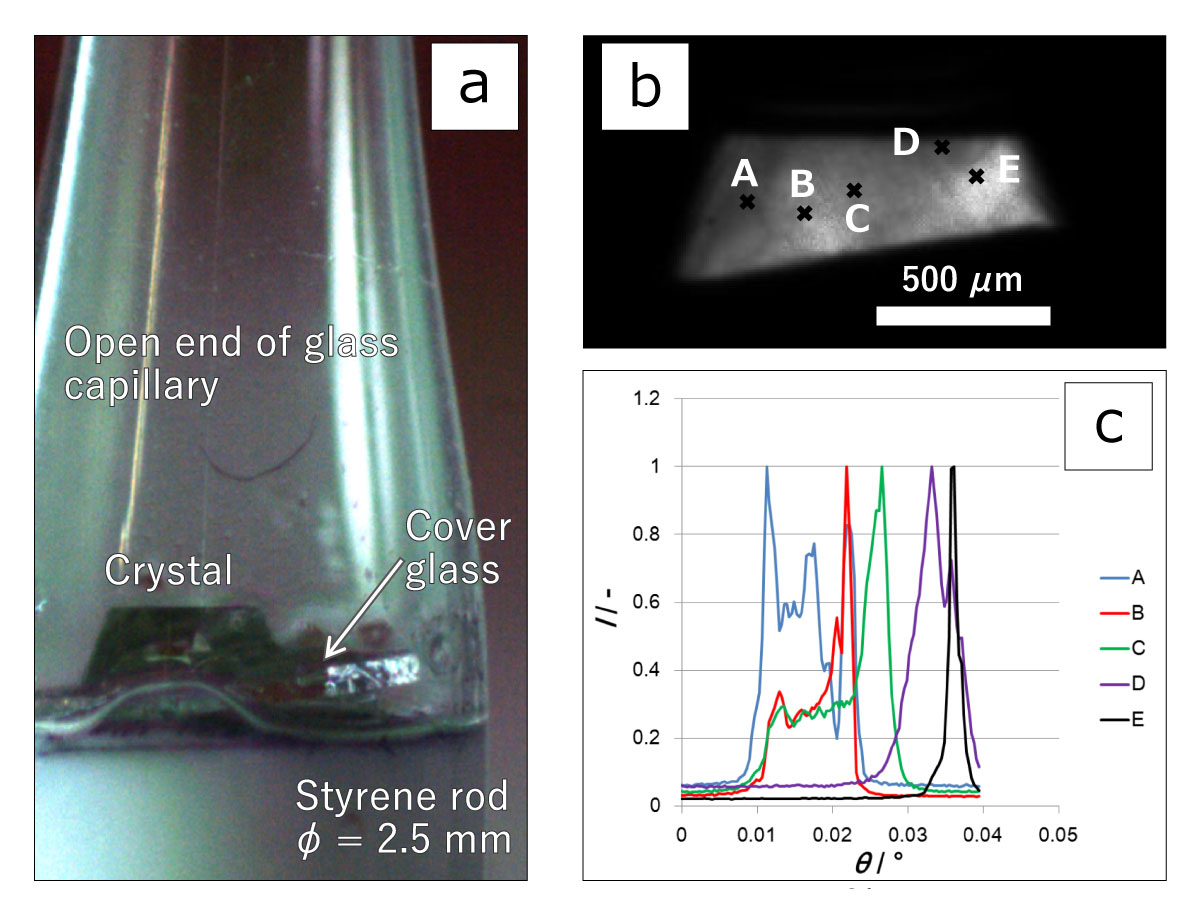
要旨Advanced Nano Step(以下AdNano)ミッションは、無重力でタンパク質結晶を成長させ、その成長する結晶の表面をこまかく観察して、「宇宙ではどうしてきれい(高品質)な結晶ができやすい(と言われている)のか」という謎を解明する実験です。抗インフルエンザ薬などの創薬に必要不可欠な高品質なタンパク質結晶は、国際宇宙ステーション(ISS)でも、数多くの実験がなされています。 地上で成長する結晶の周囲はタンパク質の濃度が小さくなり、水溶液の密度が小さくなって浮力で浮かび上がる、密度対流という流れが生じます。無重力ではこれがなくなり、物質の移動が拡散という、濃度の濃いところから薄いところへの移動のみになります。宇宙ではそのおかげで"ゆっくり"成長するため、きれいな結晶になるとこれまで言われていました。しかし、2012年に実施したNanoStepミッション(研究代表者:東北大学・塚本勝男先生)では、ニワトリ卵白リゾチーム(HEWL)というタンパク質を使い結晶の表面を観察することで、「宇宙では地上よりも速く結晶が成長する」ことがわかりました[1]。これは、これまで言われてきたことと"正反対の"結果でした。 なぜ速くなるのか?そして、速く成長するのにどうしてきれいな結晶になるのか? その理由を考えると、結晶化タンパク質以外のタンパク質や、結晶化タンパク質同士が不規則に結合したものなど、いわゆる「不純物」の存在がクローズアップされます。つまり、不純物が結晶成長を邪魔することが関係していると考えました。結晶化タンパク質よりも大きいサイズの不純物が存在して結晶の成長を阻害するのであれば、宇宙では、そのような不純物が拡散で運ばれることが少なくなり、結果として結晶の成長速度が速くなります。そして、その結果結晶に取り込まれる不純物も少なくなり、より高品質な結晶が成長するということです(図1)。 しかし、この考えを証明するためには、NanoStepミッションの結果だけでは足りません。 NanoStepミッションでは、大きな不純物がある場合についてのみ考えましたが、もし不純物の方が小さい場合はどうなるのでしょうか? 逆に宇宙の方がより多くの不純物がやってきてしまって、成長速度が遅くなり、結晶の品質も悪くなってしまうのではないでしょうか? AdNanoミッションでは、「きぼう」日本実験棟で、グルコースイソメラーゼ(GI)というタンパク質の結晶(図2)の成長する結晶表面を詳細に観察し、GIよりも小さい不純物としてNanoStepミッションで用いたHEWLを使って、その効果を明らかにします。また、実際に宇宙で成長した結晶を地上に持ち帰り、結晶品質の評価を行います。 この成果は、タンパク質の結晶化の際、どうしたら高品質化できるか、宇宙で良い結晶を作るためにはどうしたら良いのかという疑問に答え、より効率的に高品質化できる道を開くと期待されます。 実験の概要AdNanoミッションでは、結晶の成長速度と、回収結晶の品質評価を行うことを目的としています。 結晶の表面は、図2では平坦に見えますが、結晶化タンパク質の大きさ程度の高さを持つ、「ステップ」と呼ばれる段差がそこかしこにあります。簡略化して考えるため、タンパク質分子をサイコロ状に模式化した結晶表面の様子が図3です。結晶は、結晶の表面に結晶化分子を取り込んで成長します。しかし、結晶の表面にどのように取り込まれるかまで考える人は少ないのではないでしょうか?それを考えた人の名前をとって、図3のようなモデルのことを、Kosselモデルといいます。Kosselモデルでは、結晶化分子は、ステップの折れ曲り部分であるキンクと呼ばれる部分で結晶に取り込まれます。したがって、結晶が成長するときの最も重要なプロセスは、このキンクへの分子の取り込みの機構であると言えます。この機構がわかれば、本質的な事はほぼ全てわかるはずですが、残念ながら、このキンク取り込み機構をリアルタイムで可視化する事は通常の結晶では困難です。しかし、共焦点微分干渉顕微鏡といった、ハイエンドの光学顕微鏡を使えば、タンパク質の分子ステップそのものを観察することが可能です[2]。実際に共焦点微分干渉顕微鏡を用いて、成長するGI結晶表面のさまざまな分子ステップが前進する様子を動画1に示します。例えば分子がキンクに取り込まれる過程を繰り返すと、ステップ全体がそのステップに対して垂直方向に移動します。その際、ステップ上のキンクの密度がほぼ一定であれば、そのステップの前進速度を測定することで、キンクへの分子取り込み速度を求めることができます。よって、現時点で、最も本質的な結晶成長プロセスを明らかにする方法はステップ前進速度を測定することと言えます。ステップ前進速度が変わる様子を、地上と宇宙という重力の変化や不純物の濃度の変化によって系統的に測定し、その結晶の品質を評価することで、結晶の品質がどのように変化するかを明らかにするというのが本ミッションの目的です。ちなみに、この動画で動いているステップ(菱形で直線的な縞状のラインの繰り返しとして見えています)は、スパイラル成長丘という、結晶中のらせん転位という格子欠陥を中心に、渦巻き状に連続的に生成・前進する表面構造を形成するステップです。 分子ステップを観察すると、そのステップ前進速度のみならず、ステップの形状の変化によっても、不純物の効果を明らかにできます(図4)。図4(a)はGIの水溶液中でのスパイラル成長丘の様子、図4(b)は不純物としてHEWLを混入した水溶液中でのスパイラル成長丘の様子です。GIのみの方は、ステップが直線的で角が鋭いステップになっているのに対し、HEWLを混入した方は、ステップが湾曲し、所々で凹凸が存在しています。また、角が丸みを帯びています。ステップの形状がなぜこのように変化するのでしょうか? 図5に模式的に示します。図5(a)は、GIのみを含む溶液中、図5(b)はHEWLを含む溶液中を示しています。ステップは進行方向の結晶表面(テラス)上に吸着し、拡散しているGI分子を取り込みながら前進します。(a)のように邪魔をするものが何もなければ直線的な形状のままスムースに前進できます。それに対して、HEWLが存在し、ステップに取り付くと、GIのステップはそこでは前進できなくなり、迂回して進みます。その結果、ステップの形状が変化して、湾曲したり、凹凸ができたり、角が丸くなったりします。もちろん、このような阻害があればステップの前進速度も遅くなります。これらを観察することで、不純物の存在が、結晶の成長に及ぼす影響を定量的に明らかにすることが可能です。ちなみに本ミッションのAdvanced Nano Stepという名前は、「前進する ナノメーターサイズの ステップ」という意味も含んでいます。タンパク質分子のサイズはナノメーター(10-9m)程度なので、結晶表面の分子ステップが前進する様子を観察する実験であることを表しています。 さて、ここまで分子ステップを観察するという話をしてきましたが、さまざまな要因があって、実は「きぼう」では、地上で使っている共焦点顕微鏡を使うことがまだ出来ていません。「えー?それではこれまで話したことは全て宇宙では実現できないの?」と思われる人もいるかも知れません。しかし、ある工夫によって、共焦点顕微鏡と同等の測定ができるようになりました。それが、先に紹介した、NanoStepミッションで採用された光干渉法です[3]。 基本的にはNanoStepミッションと同じ装置を使って、干渉顕微鏡像の変化からステップ前進速度を求め、ステップの形状の変化をその場観察します。実際にGI結晶上にも、スパイラル成長丘を定常的に作り出し、光の干渉縞を作り出すことに成功しています(図6)。図6では、全く同じ結晶を2つの異なる顕微鏡を使って撮影しています。図6(a)は透過明視野顕微鏡像、図6(b)は二光束干渉顕微鏡像です。(a)で右側の結晶表面を見ると平坦な面にしか見えませんが、(b)では、左側の結晶と重なっていて、右側の結晶の表面から飛び出している部分を中心に、同心菱形の干渉縞が観察できます。干渉像において、同じ縞模様の示す部分は同じ高さの部分を示しています。すなわち、地図で言う等高線です。同心菱形の干渉縞が見えていると言うことは、すなわち、動画1や、図4で示した、スパイラル成長丘が存在して、ほぼ同じ間隔でステップが平行に並びつつ前進していることを示しています。AdNanoミッションの「きぼう」での実験では、この干渉縞の時間変化を観察し、ステップ前進速度および成長丘の形状を測定することで、HEWLの不純物としての影響を定量化する予定です。もちろん、それに対する地上対照予備実験では、共焦点微分干渉顕微鏡を使って測定しています。 ここで、先に行った、不純物効果について、もう一度少し詳しく説明します。NanoStepミッションでは、どうして宇宙の方が速く成長したのか? その答えについて、「宇宙の方が、溶液中に存在する不純物による結晶成長の阻害が少なくなるから」ではないかと我々は考えました。つまり、もし結晶化するタンパク質よりも大きな不純物があった場合、地上では対流によって結晶化タンパク質と一緒に成長する結晶表面に運ばれてきます。しかし、宇宙では対流がなくなるため、タンパク質の移動は、濃度の高いところから低いところに移動する"拡散"だけになります。拡散のスピードはその物質のサイズが大きいほど遅くなるため、大きな不純物は結晶化タンパク質よりも結晶表面にたどり着きにくくなり、その分結晶化の阻害が少なくなって、速く成長するようになるはずです(図1)。実際に、NanoStepミッションの時は、結晶化タンパク質にニワトリ卵白リゾチーム(HEWL)を使い、主要な不純物として、HEWLが不規則に結合した共有結合性二量体が存在するため、まさにこの関係にありました。 しかし、ここで疑問が生じます。もし不純物の方が「小さい」場合はどうなるのでしょうか?同じ考え方を推し進めると、今度は地上よりも宇宙の方が結晶表面に不純物が速くたどりつくことになり、成長は阻害されて遅くなり、かつ不純物がより多く取り込まれるため、品質も悪くなるのではないでしょうか?(図7)。 つまり、AdNanoミッションでは、 結晶化分子よりも小さい不純物が存在する場合、宇宙では地上よりも成長速度が遅くなるのか?そして結晶の品質は宇宙の方が低くなるのか? について、明らかにすることを目的としています。成長速度としては、ステップ前進速度を、表面形態としては、二光束干渉像から測定・観察することで、これらの不純物効果を明らかにすることを目標としています。以上は、「きぼう」で行う実験について主にGIの結晶成長過程のその場観察によって得られる情報を使う話ですが、AdNanoミッションでは、さらに、「きぼう」で観察した結晶を地上に持ち帰って、その品質を評価します。そのためには、その場観察で使用した結晶を、品質を損なわずに取り出し、その状態でX線結晶構造解析を行う必要があります。我々は、その方法も考えました。 実際に「きぼう」に打ち上げるその場観察用のセル(結晶を成長させる容器)には、結晶座という、結晶を固定するために樹脂製の台座がねじ込んであります。その台座を取り外し、結晶が乾燥しないように素早く密封し、かつX線を遮らずに内部が観察できるように、ガラスキャピラリーを上からかぶせる方法を考えました( 図8 (a))。キャピラリーの上方には蒸留水を染み込ませた紙ウエスを詰め込み、内部の湿度を高く保つ工夫をしました。その状態で、高エネルギー加速器研究機構のフォトンファクトリー(KEK-PF)で放射光X線トポグラフ(図8(b))を撮影し、結晶の各部分における、ロッキングカーブという、回折X線強度の角度依存性のデータを取得します(図8(c))。得られたピークの半値幅が小さいほど、結晶中の分子が揃って並んでいるということを示します。AdNanoミッションでは、このロッキングカーブ測定によって結晶の品質を評価します。また、さらにそのままSPring-8などにサンプルを移動し、分子の立体構造を解析するのに必要な回転写真も撮影します。予備実験ではKEK-PFからSPring-8に移動しながら、数日間の実験もこのセットアップで可能であることがわかりました。また1回目のフライトの回収結晶を同手法で密封し、つくばのKEK-PFから、徳島大学経由で兵庫のSPring-8まで移動したのちの測定でも、良好な回折点が得られました。 また、GI結晶に取り込まれたHEWLの分配係数を測定します。分配係数とは、溶液中の不純物の割合に対する、結晶中の不純物の割合を示します。これによって、宇宙ではHEWLが取り込まれやすくなるのか否かが明らかにできます。分配係数と結晶の品質の相関、および分配係数と結晶成長速度の相関などを明らかにすることによって、宇宙でのタンパク質結晶の高品質化にとって最も重要なポイントをあぶり出すことができると考えています。実際には、X線による品質評価に用いた回収結晶を溶解し、イオン交換クロマトグラフィーなどによって、GIに対するHEWLの割合を測定することが可能です(図9)。 実験装置AdNanoミッションでは、回収結晶の品質評価(X線結晶構造解析および分配係数測定)と結晶成長セル以外は、全てNanoStepミッションで使用した実験装置を再使用します。装置の詳細に関しては、NanoStepミッションをご参照ください。 期待される成果タンパク質の結晶化において、不純物が結晶に取り込まれることによって品質が悪化することは色々と研究されてきましたが、微小重力下における成長メカニズムと結晶品質、更には不純物の分配係数との相関に関しては、これまで誰も明らかにしていません。特に以下のポイントについて、「何故宇宙では良い結晶が得られることが多いのか」に対する答えを得るとともに、創薬の分野などに貢献できる可能性が高いと考えています。
研究代表者コメント塚本勝男先生(現・大阪大学)から、2012年度に「きぼう」で実施されたNanoStepミッションに研究分担者としてお誘い戴き、それ以来、宇宙実験に関わるようになりました。NanoStepミッション終了時に、塚本先生から今回の実験の研究代表者になることを打診され、現在に至ります。 AdNanoミッションは、2017年8月に、最初のサンプルを打ち上げ、11月から観察をスタートし、2018年1月に、回収結晶の評価までを行なっています。いくつかの目的についてはまだ達成できていませんが、思わぬ発見があり、それを元に最初の実験結果をまとめて発表しました[4]。また、回収結晶の品質評価については、技術的にいくつかクリアしなければいけない問題点がありましたが、いくつかの結果が出ましたので、論文を投稿し、現在アクセプトに向けてやり取りをしている最中です[5]。また、その他にもこのミッションに関する地上対照予備実験として、いくつかの研究成果をまとめる予定です。 宇宙実験に初めて研究代表者として関わり、研究分担者の皆様他、JAXA、JSF、AES、JAMSSなど多くの皆様のご支援・ご助力無くしては成り立たないものだということを改めて強く実感しています。是非、このAdNanoミッションを成功させ、全ての関係者の皆様と祝杯を挙げたいと思います! 参考資料参考文献
関連WEBサイト |
|
|
研究論文(Publication)
|
|